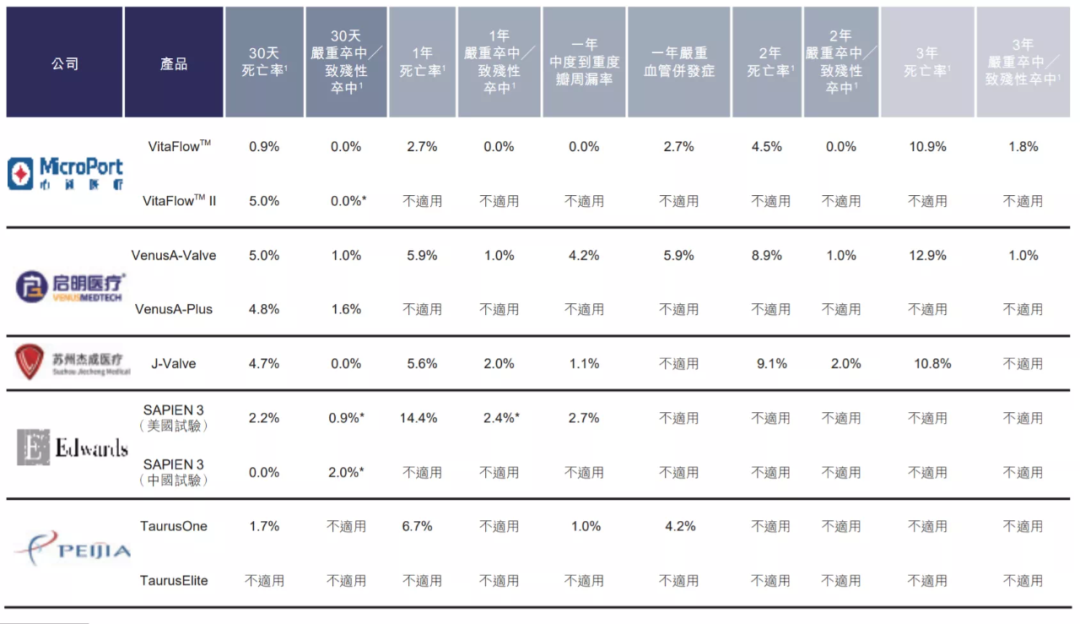
4月19日,沛嘉醫療的自膨脹主瓣系統TAVI獲批了!這是繼啟明、杰成、心通之后國產TAVI的第4張證!據悉還有更多類似產品正在拿證的路上。可以預見,連同歐美愛德華在內,瓣膜市場將形成一家外企、多家民企同臺競技的熱鬧場面!
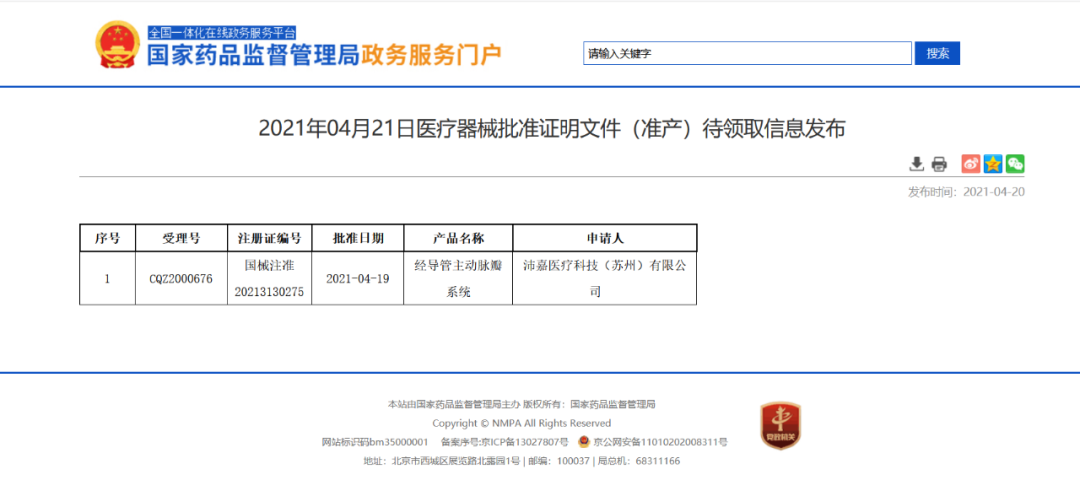
沛嘉科技(蘇州)有限公司自主研發的里程碑產品——TaurusOne? 經導管主動脈瓣系統(以下簡稱“TaurusOne?”),正式獲得藥品監督管理局(NMPA)批準上市,注冊證號:國械注準20213130275,為TAVR介入領域再添中國方案。
TaurusOne?注冊臨床試驗由中國醫學科學院阜外醫院高潤霖院士擔任主要研究者,由中國醫學科學院阜外醫院、浙江大學醫學院附屬第二醫院、四川大學華西醫院、中國人民解放軍北部戰區總醫院、哈爾濱醫科大學附屬第二醫院及中南大學湘雅二醫院共同參與完成(參考多中心臨床試驗方案機構代碼排序)。該臨床試驗方案通過CFDA(現NMPA)臨床前預審批,入組標準嚴苛。TaurusOne?一年期臨床研究數據表明其用于重度主動脈瓣狹窄具有明確的安全性和有效性,并且對于二葉瓣和三葉瓣臨床結果無明顯差異。
沛嘉醫療董事長、CEO張一表示,“TaurusOne?的上市,是沛嘉醫療發展歷程中具有里程碑意義的一站,將為國內主動脈瓣狹窄患者及TAVR介入領域的醫生提供更多的產品和方案選擇。”
包組織,并進行專有的抗鈣化技術處理;支架流入端采用增強徑向支撐力設計,以應對中國患者高鈣化及二葉瓣比例高的特點;平衡的收腰設計,在避免阻擋冠脈的同時保持較大的瓣口面積。流入端的內外雙層裙邊可以有效避免或減少瓣周漏。輸送器采用人體工程學大手柄設計,為術者操作帶來良好體驗;導管部分外徑為18Fr,采用分段式設計,使其具有良好的通過性、推送性及柔順性。
數據顯示,2020年,TAVR在全球的市場規模達50億美元,并將繼續保持高速增長。我國TAVR市場仍處藍海,前景廣闊,未來行業有望爆發式增長,預計2025年將達50.6億元人民幣。
此次TaurusOne?獲批上市,標志著沛嘉醫療正式進入TAVR產品商業化階段。該產品作為公司結構性心臟病產品線的重要基石,將通過自主研發及設計,形成產品矩陣,為臨床提供更加完備的產品組合,持續構筑沛嘉在結構性心臟病領域的全線研發與產品能力。目前公司在TAVR領域的第二代產品TaurusElite?處于提交注冊階段,第三代產品TaurusNXT?處于臨床前籌備階段,按計劃推進。
作為創新醫療器械產品,TaurusOne?憑借嚴謹扎實的前期工作,跑出獲批拿證“加速度”。這得益于監管部門對創新的鼓勵與支持,同時也驗證了沛嘉醫療在產品開發階段嚴謹創新、細致入微的精神,更詮釋了公司至善盡心,敬畏生命,追求讓臨床為滿意的產品的理念。
沛嘉醫療于2012年成立,總部位于中國江蘇蘇州,2020年5月在港交所上市(股票代碼09996.HK)。公司秉持“至善盡心,敬畏生命”的理念,始終將生命和安全放在首位,深耕技術,堅持創新,竭盡所能助力生命健康。公司定位“創新為本,心腦同治”戰略布局,專注于創新、研發及生產結構性心臟病和腦血管介入領域高端醫療器械,涵蓋主動脈瓣、二尖瓣、三尖瓣及手術附件,腦血管介入出血類、缺血類、通路類產品,構建起國內結構性心臟病和腦血管介入領域較為全面的產品組合及解決方案。
來源:沛嘉醫療